難治性脳疾患研究室
難治性脳疾患研究室について
当研究室は、アルツハイマー病などの認知症、統合失調症などの精神疾患の病態解明、早期診断、診療・ケアのための研究を行っています。ひいては、それが難病と言われるこれら疾患の有効な治療へ結びつけばという願いを込めて日夜、研究に励んでいます。
当研究室は、疾病の原因や発症機構がまだ全面的に解明されていない中枢神経系疾患に関する、山陰での一大情報発信研究施設を目指します。
| 室長 | 小西 吉裕(臨床研究部長) |
|---|
難治性脳疾患研究室の構成
| アルツハイマー病研究部門 | 副室長 欠 |
|---|---|
| ブレインバンク部門 | 副室長 小西 吉裕 (臨床研究部長) |
| 客員研究員 |
|
||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 研究スタッフ |
|

当院倫理委員会で審議・承認された臨床研究、( )内は研究責任者
- アルツハイマー病における病態関連サイトカイン遺伝子の転写・翻訳の解析に関する国際共同研究、平成17年6月16日(小西吉裕)
- アルツハイマー病脳におけるBACEの発現とその発現細胞の同定に関する研究、平成17年6月16日(小西吉裕)
- アルツハイマー病脳におけるCD59の発現に関する研究、平成17年6月16日(小西吉裕)
- 施設入所高齢者における血清亜鉛濃度の検討、平成17年6月16日(小西吉裕)
- 施設入所高齢者と大学生の味覚障害、平成17年6月16日(小西吉裕)
- リサーチ・リソース・ネットワークにおける病理検体の提供 – 厚生労働省精神神経疾患研究委託費「神経・筋疾患と慢性精神疾患等のリサーチ・リソース(剖検脳等の組織)の確保とそのシステム整備に関する研究」の分担研究の展開として、平成19年2月27日(小西吉裕)
- 確保されたリサーチ・リソースとしての剖検脳からの凍結脳組織片、固定脳組織切片、培養細胞ならびに核酸・蛋白質バンクの確立 – 厚生労働省精神神経疾患研究委託費「神経・筋疾患と慢性精神疾患等のリサーチ・リソース(剖検脳等の組織)の確保とそのシステム整備に関する研究」の分担研究として、平成19年2月27日(小西吉裕)
- ヒト脳組織を用いての組織培養の展開とその分子生物学・生化学的解析、平成19年2月27日(赤津裕康)
- アルツハイマー病脳におけるα1-chimaerin発現に関する研究、平成19年12月5日(小西吉裕)
- アルツハイマー病脳におけるreticulon 3の発現に関する研究、平成19年12月5日(小西吉裕)
- アルツハイマー病脳におけるBACEの発現に関する米国Caucasianと日本人との比較研究、平成20年8月20日(小西吉裕)
- 統合失調症におけるBACE mRNA発現および蛋白・酵素レベルに関する研究、平成21年11月17日(小西吉裕)
- 認知症(アルツハイマー病等)の診断および認知症に関するバイオマーカーに関する研究、平成22年10月19日(小西吉裕)
- 精神科医療のニーズとアウトカムに関する研究、平成23年6月20日(松下幸生、黒木俊秀)
- 嗅粘膜組織由来の初代培養細胞を用いた神経変性疾患の診断の試み、平成23年9月21日(小西吉裕)
- Whole genome amplification法による貴重かつ希少なヒト死後試料からのトリプレット・リピートの証明、平成23年12月19日(小西吉裕)
- 嗅粘膜組織由来の初代培養細胞を用いた神経変性疾患の診断の試み(追加審議)、平成25年5月20日(小西吉裕)
- 認知症(アルツハイマー病等)の診断および認知症に関するバイオマーカーに関する研究(追加審議)、平成25年 12月16日(小西吉裕)
- 鳥取臨床科学研究会誌掲載論文の個人情報匿名化について、平成26年6月16日(小西吉裕)
- アルツハイマー病脳におけるBACEの発現に関する米国Caucasianと日本人との比較研究(追加審議)、平成26年12月15日(小西吉裕)
- 統合失調症におけるBACE mRNA 発現および蛋白・酵素レベルに関する研究(追加審議)、平成27年3月16日(小西吉裕)
- 胎生マウス脳からの神経細胞培養法の確立、平成27年4月14日(小西吉裕)
- アルツハイマー病脳におけるα1-chimaerin 発現に関する研究(追加審議)、平成27年7月15日(小西吉裕)
- アルツハイマー病脳におけるTNF受容体type1とtype2の発現の違いに関する研究、平成28年1月12日(小西吉裕)
- アルツハイマー病診断のためのバイオマーカーとしての髄液中α1-chimaerin測定の有用性について、平成28年1月12日(小西吉裕)
- βアミロイド産生・蓄積の制御に関与しうる脳内タンパク質の発現のヒト剖検脳を用いた解析、平成28年11月8日(小西吉裕)
- アルツハイマー病脳におけるα1-chimaerin発現に関する研究(タンパクレベルの解析、追加審議)、平成28年11月8日(小西吉裕)
- アルツハイマー病脳におけるCD59の発現に関する研究(再開)、平成28年11月8日(小西吉裕)
当院利益相反審査委員会で報告された臨床研究
上記の臨床研究課題は、原則として、本件についても報告・審査されている。

研究室の様子
最近のトピック
2018年3月、当院の臨床研究部難治性脳疾患研究室が行っています研究が、平成29年度に引き続き、東北大学加齢医学研究所との平成30年度共同研究課題に採択されました。
2018年3月、当院の臨床研究部難治性脳疾患研究室が行っています研究が、平成29年度に引き続き、東北大学加齢医学研究所との平成30年度共同研究課題に採択されました。
2018年2月、Tottori J. Clin. Res.に、「Reduced CD59 expression is associated with high membrane attack complex (MAC) levels in neurons of Alzheimer’s disease」を発表しました。
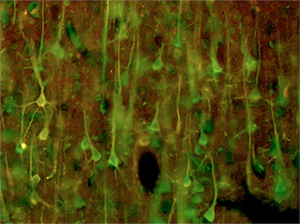
High pathology control 脳のMAP2 (Green) とCD59 (Red)の二重蛍光染色merge像。
細胞体が黄色のが、CD59 発現陽性の神経細胞。
2017年9月、小西臨床研究部長が執筆の雑誌巻頭の論説「Are Inflammatory Alterations a Cause or Consequence of Neurodegeneration in Alzheimer’s Disease?」 が、Journal of Immunology, Infection and Inflammatory Diseases,Vol.2, Issue2 に 掲載されました。
2016年7月、かつて当院臨床研究部難治性脳疾患研究室に在籍していた永江知音博士(Ph.D.)がアルツハイマー病脳でのTNFα、およびTNF受容体の変化につき研究した結果が、論文としてJournal of Clinical and Cellular Immunologyに発表されました。タイトルは、「Cytokines and Cytokine Receptors Involved in the Pathogenesis of Alzheimer’s Disease」です。
本論文は、私たちの研究室のデータ以外に、アルツハイマー病の病態発生における炎症性因子の関与について、最近の知見も含めた総説となっています。
Inflammatory mechanisms are implicated in pathology of Alzheimer’s disease (AD). However, it is unclear whether inflammatory alterations are a cause or consequence of neurodegeneration leading to dementia. Clarifying this issue would provide valuable insight into the early diagnosis and therapeutic management of AD. To address this, we compared mRNA expression profiles of cytokines in the brains of AD patients with “non-demented patients with AD pathology” and non-demented healthy control (ND) subjects. “Non-demented patients with AD pathology” is referred to as high pathology control (HPC) patients that are an intermediate subset between AD and ND. HPC represents a transition between normal aging and early stage of AD, and therefore, is useful for determining whether neuroinflammation is a cause or consequence of AD pathology. We observed that immunological conditions that produce cytokines in the HPC brain were more representative of ND than AD. To validate these result, we investigated the expression of inflammatory mediators at the protein level in postmortem brain tissues. We examined the protein expression of tumor necrosis factor (TNF)a and its receptors (TNFRs) in the brains of AD, HPC, and ND patients. We found differences in soluble TNFa and TNFRs expression between AD and ND groups and between AD and HPC groups. Expression in the temporal cortex was lower in the AD brains than HPC and ND. Our findings indicate that alterations in immunological conditions involving TNFR-mediated signaling are not the primary events initiating AD pathology, such as amyloid plaque and tangle formation. These may be early events occurring along with synaptic and neuronal changes or later events caused by these changes. In this review, we emphasize that elucidating the temporal expression of TNFa signaling molecules during AD is important to understand the selective tuning of these pathways required to develop effective therapeutic strategies for AD.
2015年3月、当院臨床研究部難治性脳疾患研究室が滋賀医科大学神経難病研究センターの遠山育夫教授、加藤智子助教らと共同で行っています研究の第一報が、Neuroscience Letters に発表されました。タイトルは「Alpha1-chimaerin, a Rac1 GTPase-activating protein, is expressed at reduced mRNA levels in the brain of Alzheimer’s disease patients」です。
2014年9月、私たちの研究「アルツハイマー病脳でのGDNF受容体発現とグルタミン酸による神経細胞死との関係」の成果が、Journal of Neuroscienceに発表されました。
Konishi, Y., Yang, L., He, P., Lindholm, K., Lu, B., Li, R. and Shen, Y. Deficiency of GDNF receptor GFRα1 in Alzheimer’s neurons results in neuronal death. J. Neurosci. 34, 13127-13138, 2014
シナプスを介する神経細胞間ネットワークは、脳機能の発達、成熟、維持、および修復には欠かすことのできないもので、神経栄養因子はその中で重要な役割を演じています。神経栄養因子はアルツハイマー病やパーキンソン病などの神経変性疾患の治療薬としての可能性について、よく論じられて来ました。その神経栄養因子の1つであるGDNF (glial cell line-derived neurotrophic factor) は、中脳ドパミン系神経細胞に対して生存促進作用を有する因子として発見され、米国ではすでにパーキンソン病に対する臨床治験も行われています。その後、GDNFは他の神経細胞にも作用することが判明しましたが、アルツハイマ-病での効果は知られていませんでした。 我々はまず、実際のアルツハイマー病の脳では、GDNF受容体alpha1 (GFRα1)の発現が低下していることを発見しました。しかも、健常高齢者の脳では、GDNFの刺激によってGFR alpha1の発現は高まりますが、アルツハイマー病脳では亢進しないことも判明しました。
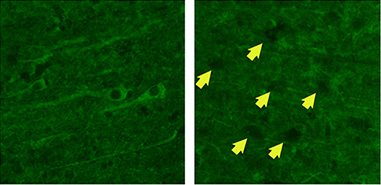
大脳皮質神経細胞におけるGFRα1の発現(左がアルツハイマー病例、右がコントロール例。黄色の矢印はGFRα1抗体でラベルされない神経細胞を示す)
一方、グルタミン酸は、シナプスを介して神経細胞間ネットワークにおいて、情報伝達を担う重要な興奮性神経伝達物質の一つです。 グルタミン酸受容体を介して興奮伝達のみならず、記憶、学習、入力依存性の神経回路形成に関与し、また、様々な病態で起こる神経細胞死や、アルツハイマー病、統合失調症の病態にも深く関わっているとされています。アルツハイマー病では、グルタミン酸受容体が病的に過剰刺激されるために神経細胞障害が起こるとされ、従って、 NMDA 受容体拮抗薬メマンチンが、コリンエステラーゼ阻害剤(アリセプト)に代わる、もしくはそれと併用すべき治療薬として推奨されているのです。
そして興味深いことに、神経細胞に GDNF を添加する際、あらかじめAMPA 受容体や NMDA 受容体の機能を拮抗薬で阻害しておくと、GFRα1 の発現が、健常高齢者では抑制され、アルツハイマー病では反対に促進されることを見いだしました。よって、アルツハイマー病例には、GDNF 単独では無効かもしれないし、GDNF を効かすにはグルタミン酸受容体拮抗薬の併用がよいのかもしれませんが、適用患者を誤ると、反対の作用が出現するかもしれないことが推測されます。さらに、アルツハイマー病に対し、メマンチンなどのNMDA 受容体拮抗薬単独でも効きが悪いかもしれなく、GDNF との組み合わせが良いかもしれません。
番外編:医学史
鳥取臨床科学研究会誌第6巻第2号に、小西臨床研究部長が7年間住んだ岡山県津山市に縁のある「宇田川3代」について紹介されています。2007年に科学雑誌「ニュートン」でも紹介されたので、ご記憶のある方もおられるかと思います。鳥取県に縁のある鳥取藩医の稲村三伯についても触れています。その解説は以下のような書き出しで始まります。
記憶が定かではないが、10年以上も前に、医学史も専門である高橋昭, 元名古屋大学神経内科学教授が、ある学会(神経学会だったと記憶している)にて江戸時代に西洋の内科 学を国内にはじめてもたらした蘭学者について、医学史の講演の中でその話があった。それに関する情報を得るために津山へも足を運んだという。高橋昭元教授は日本内科学会誌 においてもそれを紹介しているが、この事実に大きな衝撃を受けたことを記憶している。何故なら、江戸時代の蘭学について、我々は『解體新書』とそれを訳述した杉田玄白、前野 良沢の2人くらいの名前、そして医学を学んだ者なら緒方洪庵は知っている。そのくらいであろう。緒方洪庵も岡山県(足守藩)が生んだ大変な偉人であるが、地域こそ違うが同じ 岡山県(津山藩)の誇り、宇田川家の人々については津山市民でさえ全員が知っている訳ではない。津山駅前に箕作阮甫像があることからも、まだ同じ頃に活躍した箕作家の人々 の方がよく知られている印象を受ける。杉田玄白、前野良沢らの『解體新書』は大きな影響をもたらしたことには違いなく、それに異論を挟む気など毛頭ないが、あくまでも基礎医 学の解剖学書である。それで医学の臨床を実践することはできないのであり、西洋医学を臨床へ実践に移す第一歩として、「江戸時代に西洋の内科学を国内にはじめてもたらした蘭学者」である宇田川玄随(1755-1797)の功績はもっと全国に知られるべきである。
宇田川玄真、宇田川榕菴の詳細な紹介の他、その後の宇田川家、また緒方洪庵についても、触れています。
科学雑誌「ニュートン」の編集長は、以下の様に締めくくっています。
「宇田川、箕作両家は日本の科学に大きく貢献しており、もっと評価されていい」と。
アルツハイマー病研究部門
| 部門責任者 | 小西 吉裕 Yoshihiro Konishi, M.D., Ph.D. |
|---|

Head, Yoshihiro Konishi,MD,phD
当研究部門は、アルツハイマー病の発症機構を分子のレベルから研究しています。ひいては治療法開発に役立つ情報発信ができれば幸いです。
米国アリゾナ州 Banner Sun Health Research Institute、米国Blanchette-Rockefeller Neuroscience Institute、滋賀医科大神経難病(旧、分子神経科学)研究センター、国立精神・神経医療センター神経研究所、京都大学iPS細胞研究所、東京都健康長寿医療センター研究所、東北大学加齢医学研究所等と共同研究を行っています。
職歴
| 平成元年 | 国立精神神経センター神経研究所研究員 (ヒューマンサイエンス科学振興財団流動研究員) |
|---|---|
| 平成4年 | シカゴ大学薬理生理学部門研究員 (長寿科学振興財団海外派遣流動研究員) |
| 平成9年 | 川崎医科大学神経病理講師 |
| 平成10年 | アリゾナ州Sun Health Research Institute研究員 |
| 平成14年 | 美作大学助教授 |
| 平成17年 | 滋賀医科大学分子神経科学研究センター客員准教授 |
| 平成19年 | 国立病院機構鳥取医療センター臨床研究部長 |
研究内容
アルツハイマー病の分子病態の解明
- アミロイドと相互作用する分子の病態への関与について
- 炎症性因子の病態への関与について
- アルツハイマー病患者の皮膚線維芽細胞からiPS技術により神経細胞を得て、不死化株細胞で得た結果を検証する
ブレインバンク
皮膚線維芽細胞を用いたアルツハイマー病の早期診断のためのバイオマーカーの開発(当研究室は60 例の患者由来の皮膚線維芽細胞を有しています)
アルツハイマー病関連の国際英文誌のeditor やreviewer、海外のアルツハイマー病や自然科学研究関連財団のgrant reviewer を務めています。
所属学会
日本認知症予防学会評議員
Society for Neuroscience(米国)、ISTAART(米国)
主な業績
研究費
文科省、厚労省、ヒューマンサイエンス振興財団、長寿科学振興財団、内藤記念科学振興財団、小林孫兵衛記念医学振興財団、成茂科学神経科学研究基金、米国Alzheimer’s Associationなど
学会発表
免疫学会、薬理学会、内藤国際カンファレンス、Taniguchi Symposiaなどにシンポジストとして発表。研究結果はInternational Conference on Neuroimmunomodulation (Bethesda)、International Conference on Alzheimer’s Disease (Washington, DC)でシンポジウムに取り上げられた。
主な論文発表
Neuron 4, 429, 1990. J. Biol. Chem. 268, 11208, 1993
Int. J. Dev. Neurosci. 13, 241, 1995. Ann. N.Y. Acad. Sci. 840, 107, 1998
J. Neurosci. 22, 3025, 2002. Am. J. Pathol. 161, 1567, 2002
J. Neurosci. 24, 1760, 2004. Neuropathology 25, 220, 2005(以降は下記)
最近の研究業績
Award 受賞
-米国Alzheimer’s Association から2008 年にA new Investigator Research Grant Award を受賞
共同研究事業
-東北大学加齢医学研究所共同研究「アルツハイマー病病態へのα1-chimerin とアミロイド相互作用機序の関与(平成23年度、25年度、29年度、30年度)
-Alere, Inc., Blanchette-Rockefeller Neuroscience Institute「アルツハイマー病の診断におけるERK AD-Index 臨床実現可能性試験」(平成22、23、24年度)
-米国NIH の日米共同研究事業により、Banner Sun Health Research Institute との共同研究(終了)
論文発表
-Multiple cytokines are involved in the early events leading to the Alzheimer’s disease pathology. Tottori J. Clin. Res. 2008, 1, 359-396
-Cytokine expression profiles in the brain of non-demented control patients with increasing Alzheimer’s disease pathology, in comparison with normal control and Alzheimer’s disease patients. Tottori J. Clin. Res. 2008, 1, 152-168
-Expression of reticulon 3 in Alzheimer’s disease brain. Neuropathol. Appl. Neurol. 2009, 35, 178-188
-Expression and localization of lactoransferrin mRNA in the cortex of Alzheimer’s disease. Neurosci. Lett. 2009, 452, 277-280
-Immunocytochemical characterization of highly passaged primary astrocytes cultures from autopsied aged human brain. Tottori J. Clin. Res. 2009, 2, 121-141
-The involvement of both progenitor and mature oligodendrocytes in remyelination following ethidium bromide-induced demyelination in the mouse spinal cord. Tottori J. Clin. Res. 2009, 2, 245-255
-Infiltration of T lymphocytes and expression of ICAM-1 in the hippocampus of patients with hippocampal sclerosis. Acta Histochem. Cytochem. 2010; 43:157-162
-Expression profiles of cytokines in the brains of Alzheimer’s disease (AD) patients, compared to the brains of non-demented patients with and without increasing AD pathology. J. Alzheimer Dis. 2011, 25, 59-76
-Expression and localization of Mitochondrial ferritin mRNA in Alzheimer’s disease cerebral cortex. PLoS ONE 2011, 6(7)
-Forschungstrends bei klinischen Versuchen betreffs neurotrophischer Faktoren für Alzheimer Krankheit. Tottori J. Clin. Res. 2011, 4, 79-84
-Diagnostic de la malade d’Alzheimer á l’aide de matériaux autres que les tissus cérébraux et le liquid céphalo-rachidien. Tottori J. Clin. Res. 2011, 4, 85-92
-Cerebrospinal fluid biomarkers for the diagnosis of Alzheimer’s disease. Tottori J. Clin. Res. 2011, 4, 172-185
-Reduction of β-amyloid accumulation by reticulon 3 in transgenic mice. Curr. Alzheimer Res. 2013, 10, 135-142
-Differential expression of type 1 and 2 receptors for TNF-α in neurons and microglia from Alzheimer’s disease and normal healthy elderly control brains. Tottori J. Clin. Res. 2013, 5, 143-153
-Deficiency of GDNF receptor GFRα1 in Alzheimer’s neurons results in neuronal death. J. Neurosci. 2014, 34, 13127-13138
-Viability of primary hippocampal neurons cultured from different knockouts of tumor necrosis factor receptor subtypes. Tottori J. Clin. Res. 2014, 6, 49-59
-Alpha1-chimaerin, a Rac1 GTPase-activating protein, is expressed at reduced mRNA levels in the brain of Alzheimer’s disease patients. Neurosci. Lett. 2015,591, 19-24
-Cytokines and cytokine receptors involved in the pathogenesis of Alzheimer’s disease. J. Clin. Cell. Immunol. 2016, 7, 4
-Are Inflammatory Alterations a Cause or Consequence of Neurodegeneration in Alzheimer’s Disease?」 、Journal of Immunology, Infection and Inflammatory Diseases. J. Immunol. Infect. Inflammat. Dis. 2017, 2, 007e
-PROTOCOL: Cultures of biopsy-derived skin fibroblasts. Tottori J. Clin. Res.2017, 9, 56-76
-Reduced CD59 expression is associated with high membrane attack complex (MAC) levels in neurons of Alzheimer’s disease. Tottori J. Clin. Res. 2017, 9, 77-89
ブレインバンク部門
| 部門責任者 | 小西 吉裕 Yoshihiro Konishi, M.D., Ph.D. |
|---|
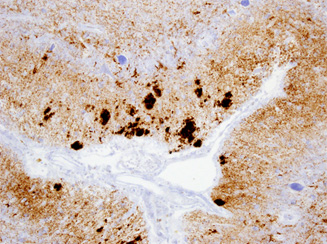
CJDのMM1+2型の異常プリオン抗体による免疫組織染色像(小脳)
トピック
小西臨床研究部長の論文「Autopsy case of pure akinesia showing pallidonigro-luysian atrophy. Neuropathology 25, 220-227, 2005」は、世界的に見て、引用件数の非常に多い神経病理関係の論文として知られています。
当医療センター臨床研究部のブレインバンクには、研究使用を目的に、Alzheimer 病、schizophrenia、multiple system atrophy、progressive supranuclear palsy、Parkinson 病、Lewy body disease、CJD、脊髄小脳変性、DRPLA、PNLA、Machado-Joseph 病、Huntington舞踏病、 ennedy-Alter-Sung 症候群などの凍結脳やホルマリン固定脳を保存しています。使用希望者には、厳正な倫理委員会の審査の上で、これらの剖検脳は研究目的に用されています。亡くなられたご本人には役には立ちませんが、同じ病気で苦しんでおられる方々に、1 日でも早く特効的治療法が見つかることを信じて、ブレインバンクを運営しています。
さらに、当医療センターは、我が国で最も歴史が古く、世界中に剖検脳を研究用に提供し続けている福祉村病院長寿医学研究所ブレインバンク(責任者:赤津裕康 研究所副所長)、および、保存脳の数では本邦随一の健常高齢者脳をも有する東京都健康長寿医療センター高齢者ブレインバンク(責任者:村山繁雄 ブレインバンク部長)、死 後の献脳に基づくブレインバンクである精神疾患死後脳バンク(責任者:丹羽真一 福島県立医科大学医学部精神医学講座教授)と共同研究を行っています。長寿医学研究 所の名誉所長の堀映先生は、当院臨床研究部に在籍されていましたし、副所長の赤津裕康先生ともに、当臨床研究部の客員研究員です。
また、新鮮剖検脳から、アストロサイトなどの生きた細胞をin vitro で維持できる体制作りをしています。生きた細胞でないと、新しく開発された治療薬の本当の薬理効果はわかりません。
また、世界的に広く知られている米国アリゾナ州Banner Sun Health Research Institute brain bank とも、アルツハイマー病の共同研究を行っています。その責任者であるDr.Thomas Beach, MD, PhD が来鳥され、当院で講演頂いています。
最近の脳剖検例
CJD、MSA、PSP、schizophrenia、argyrophilic grain disease、mixed dementia、Alzheimer病、normal control brain など。
最近の講演
平成24年2月14日、ブレインバンクでは世界的に名が知られ、米国のアルツハイマー病の神経病理の中心的病理学者の1人でもあるBanner Sun Health Research Institute (Sun City, AZ, USA)のDr. Thomas G. Beach (MD, PhD)をお招きし、”A cholinergic-amyloid-tau fusion hypothesis: Evidence from animal and human studies”というタイトルで講演頂きました。
平成26年のRRN研究班会議では、生前アルツハイマー病と診断され、剖検にて神経原線維変化型老年期認知症(NFTD)+嗜銀顆粒性認知症(DG)と考えられた高齢者認知症の1剖検例、を発表しました。
最近の論文発表
-A case of cerebral infarction with separate episodes of embolism within a 12-year interval, associated to mild Alzheimer-type lesions identified at autopsy. Tottori J. Clin. Res. 9(2), 164-175, 2017
-Immunohistochemistry of abnormal prion protein PrPSc in an autopsy case of sporadic type MM1 + 2 Creutzfeldt-Jakob disease (CJD). Tottori J. Clin. Res. 9(2), 176-189, 2017
-An autopsy case of the Kennedy-Alter-Sung type of familial spinal and bulbar muscular atrophy: Demonstration of a CAG repeat in the androgen receptor gene using whole genome amplification. Tottori J. Clin. Res. 9(2), 190-204, 2017